
试验设计 试剂和饮食:低聚木糖;木二糖(X2);木三糖(X3);木四糖(X4);木五糖(X5);四种半纯化饮食;低脂饮食(LFD)、高脂饮食(HFD)、含5%XOS的HFD(LXD)和含10%XOS的HFD(HXD),饮食组成见表1。
XOS成分的分析:使用薄层色谱法(TLC)和高效液相色谱法(HPLC)对XOS的组成进行鉴定和定量;HPLC分析发现,XOS主要由56%的X2、42%的X3和2%的X4组成(图1)。
动物实验:选择36只雄性C57BL/6J小鼠(8周龄,体重=20-21克),经过一周的适应性训练,将小鼠随机分为四组(每组9只),分别喂食四种食物中的一种,即LFD、HFD、LXD和HXD,为期12周;将小鼠安置在塑料笼子里(每个笼子3只),温度为23℃,光暗周期为12/12小时,每2天给予小鼠新鲜的食物,并允许小鼠自由地获得食物和水;每2天记录一次食物消耗量,每3周测量一次体重,在第12周收集粪便;在第12周结束时,所有的小鼠禁食12小时,在异氟烷吸入麻醉后处死,通过心脏穿刺获得血样,放入含有肝素的试管,取出器官,称重并保存在-80℃以备进一步分析。 口服葡萄糖耐量试验(OGTT):在第0、3、6、9和12周末,小鼠禁食6小时,口服2 g/kg体重的葡萄糖,进行口服葡萄糖耐量试验(OGTT);用便携式血糖仪在0、30、60、90和120分钟测定尾静脉血的血糖水平,绘制葡萄糖浓度-时间曲线以检测血糖水平的变化,并计算OGTT的曲线下面积(AUC)。 血浆脂质组学分析:在100 μL血浆样品中加入300 μL甲醇和1 mL甲基叔丁基醚(MTBE)进行代谢物提取;在12000 rpm下离心10分钟后,收集上清液并转移到小瓶中进行分析。 粪便中16S rRNA基因的测序分析:使用QIAamp® DNA Mini Kit(Qiagen, Valencia, CA, USA)提取粪便样品中的细菌总DNA;使用Nano-Drop 1000分光光度计(Nano-Drop Technologies, Wilmington, DE)检测提取的DNA的质量和数量;使用商业正向引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVG GGTWTCTAAT-3′)对V3-V4区域的16S rRNA基因进行扩增;扩增子用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences, Union City, CA, USA)进行纯化,并用QuantiFluor™ST(Promega, USA)进行定量;测序工作在上海迈瑞生物医药科技有限公司进行。使用Trimmomatic v0.33对微生物组数据进行处理;使用UPARSE对相似度为97%的操作分类单位(OTU)进行聚类,使用UCHIME识别并删除嵌合序列;用RDP分类器算法对照Silva(SSU123)16S rRNA数据库,用70%的置信度阈值分析每个16S rRNA基因序列的分类学。通过计算Chao 1和Shannon指数评估Alpha多样性;测序深度的合理性和效率用稀疏分析来确定。Beta多样性通过计算未加权UniFrac距离并通过原理坐标分析(PCoA)图进行可视化评估,并通过层次聚类分析来呈现微生物群落之间的差异。通过线性判别分析效应大小(LEfSe)来区分四组中的关键属种,线性判别分析(LDA)显著性阈值≥4.0,数据在Majorbio I-Sanger云平台(www.i-sanger.com)的免费在线平台上进行分析。 试验结果 (1)补充XOS对身体和器官重量的影响 由表2可知,四组小鼠之间在食物摄入和能量消耗方面没有明显的差异,尽管开始时所有组别都使用了体重相近的小鼠,但12周后,HFD组的小鼠的体重明显高于LFD组;用HFD喂养的小鼠平均体重比正常咀嚼饮食的小鼠高36.86%,表明高脂饮食能够诱导肥胖症,且与HFD组相比,LXD和HXD组小鼠的平均体重明显较轻;LXD组和HXD组小鼠的平均体重分别比HFD组小鼠的平均体重低12.22%和26.33%;各组小鼠的心脏、肾脏和睾丸等器官的重量没有明显差异,但HFD组小鼠的肝脏重量比HXD组重24.88%,说明XOS可以减少肝脏中的脂质沉积;HFD组小鼠的附睾脂肪、肾周脂肪和肠系膜脂肪重量比HXD组高51.00%、59.63%和67.77%,表明XOS能够影响身体的脂质代谢。
(2)补充XOS对葡萄糖耐量的影响 如图2所示,喂食不同饮食前所有组别的小鼠在血液中显示出类似的反应,在口服葡萄糖后30分钟出现峰值,且各组之间的葡萄糖AUC和空腹血糖水平没有明显差异,而用不同的饮食喂养12周后,差异显著;HFD组的小鼠在口服葡萄糖后30分钟的血糖水平比HXD的高24.20%,表明葡萄糖耐量受损,此外,与HXD组相比,HFD组的葡萄糖AUC显著升高。 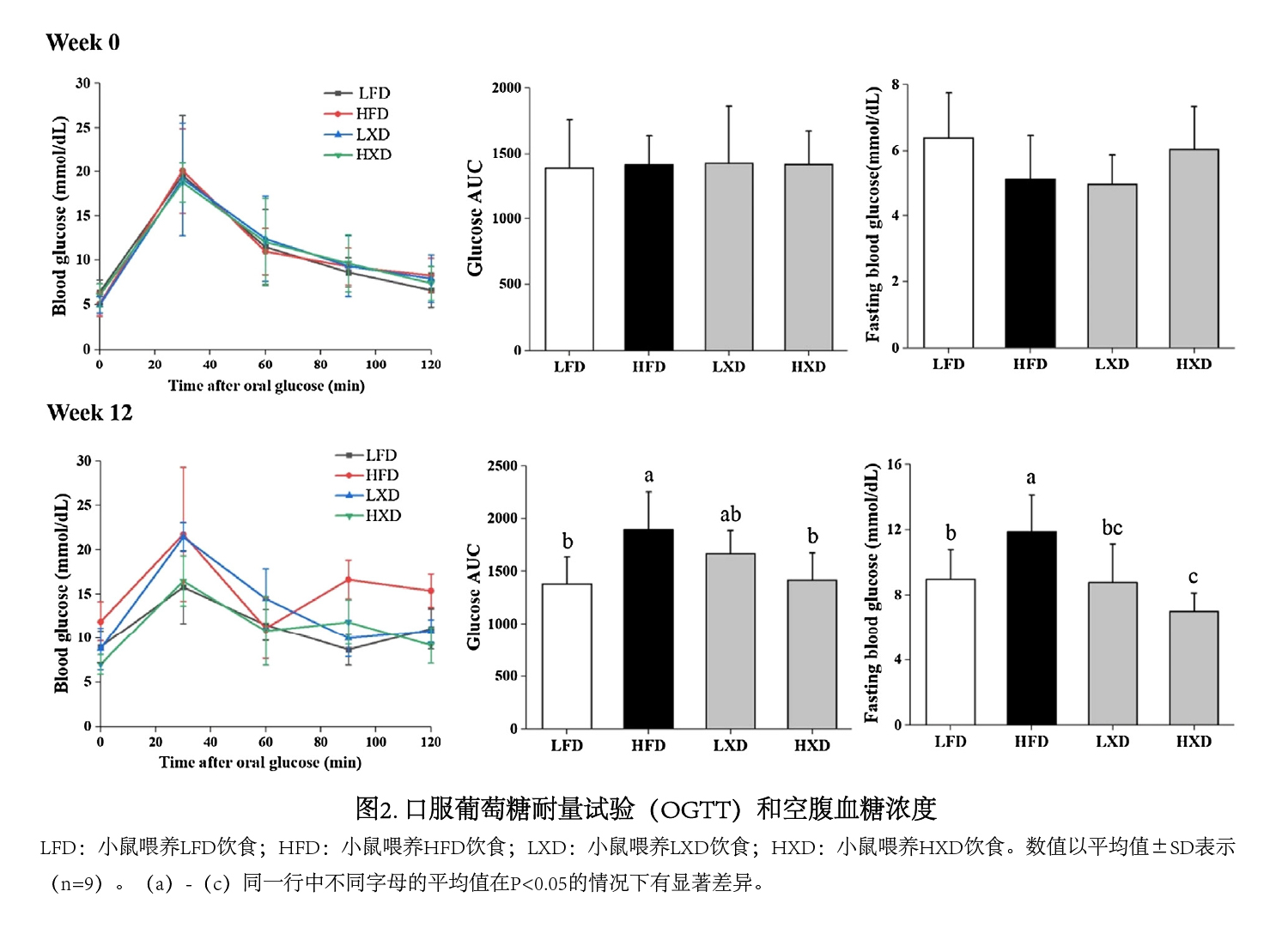 (3)补充XOS对血浆代谢物的影响 如图3A所示,PLS-DA模型分析的数据显示,LFD、HFD、LXD和HXD组的小鼠产生的这些代谢物落在不同的区域(R2Y=0.648,Q2=0.283);OPLS-DA分析显示,与LFD(R2Y=0.849,Q2=0.3)(图3B和D)和HXD(R2Y=0.968,Q2=0.731)组相比,HFD组小鼠的血浆代谢模式明显改变。
由表3可知,在有或没有XOS的情况下,用高脂饮食喂养的小鼠血浆中31种脂质的比例发生了明显的变化,这些脂质分子属于神经酰胺、甘油一酸酯、二酰甘油、甘油磷脂、甘油磷酸甘油酯和神经鞘磷脂类,且这种变化与XOS的剂量有关;HFD中XOS的补充主要降低了某些脂质的含量,降低幅度为2-6倍,尽管与HFD组相比,在HXD组也观察到一些脂质水平的增加。
(4)XOS对肠道微生物群的影响 实验结束后收集新鲜粪便样本,从24个样本中共获得1337157条细菌16S rDNA基因V3-V4区的高质量序列,序列的平均读数为55715,范围为33689至74444;所有的序列被聚类为502个OTU,相似度为97%。图4A显示,在实验结束时,喂食HXD的小鼠比喂食HFD的小鼠的Chao 1指数显著下降,表明10%的XOS补充导致微生物群落的丰富度下降;图4B显示,相比之下,LXD和HXD与HFD相比没有改变Shannon指数,表明饮食中XOS的补充没有改变微生物群落的多样性;图4C显示,基于Unweighted UniFarc原理坐标分析(PCoA)的β多样性分析表明,LFD、HFD和两个XOS处理组之间的肠道微生物群有明显的集群;此外,图4D显示,分级聚类分析的结果可以将XOS组与LFD和HFD组明确分开。
如图5A所示,在HFD组中,与LFD组相比,厚壁菌门的丰度和厚壁菌门与拟杆菌门的比例(F/B)有所增加,而补充XOS则部分逆转了高脂引起的变化;图5B显示,在科水平上,与LFD相比,HFD降低了双歧杆菌的丰度,而HXD可以逆转HFD引起的影响。此外,在HFD中补充10%的XOS也可以增加Lachnospiraceae的丰度。为了确定在属水平上对4种试验饮食反应不同的特定细菌系统类型,采用了LEfSe分析,以4作为LDA得分的阈值,图5C显示,与HFD组相比,观察到双歧杆菌、Lachnospiraceae_NK4A136_组和Roseburia在HXD组的丰度明显增加,综上所述,结果表明,补充XOS可以调节HFD饮食下小鼠的肠道菌群变化。
试验结论 本研究结合血浆代谢谱和肠道微生物群分析,研究了XOS在小鼠中的抗肥胖活性和可能的机制,研究结果表明,在饮食中补充5%和10%的XOS可以显著减缓体重的增加并改善葡萄糖不耐受;脂质组分析显示,血浆中的31种代谢分子,特别是神经酰胺和二酰甘油的种类发生了变化,这与XOS的补充有关。此外,肠道微生物群分析显示,XOS改变了肠道微生物群的组成,使双歧杆菌属、Lachnospiraceae_NK4A136_group和Roseburia的相对数量增加,总之,补充XOS可以减少肥胖症的发展,改善葡萄糖耐受不良,并改变血浆脂质谱和肠道微生物群组成。 参考资料: Zhang C ,Abdo A A A ,Kaddour B , et al.Xylan-oligosaccharides ameliorate high fat diet induced obesity and glucose intolerance and modulate plasma lipid profile and gut microbiota in mice[J].Journal of Functional Foods,2020,64103622-103622. |