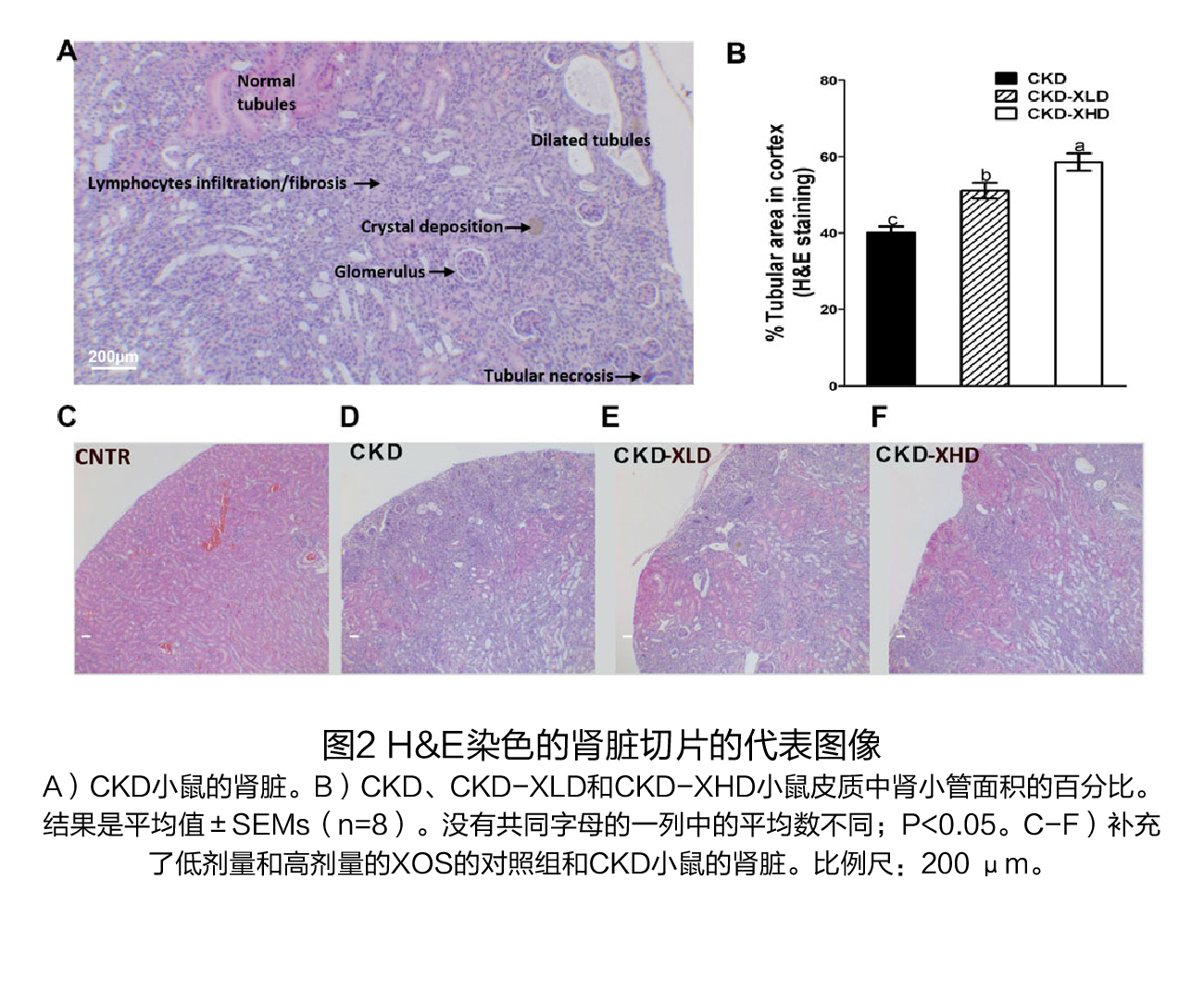
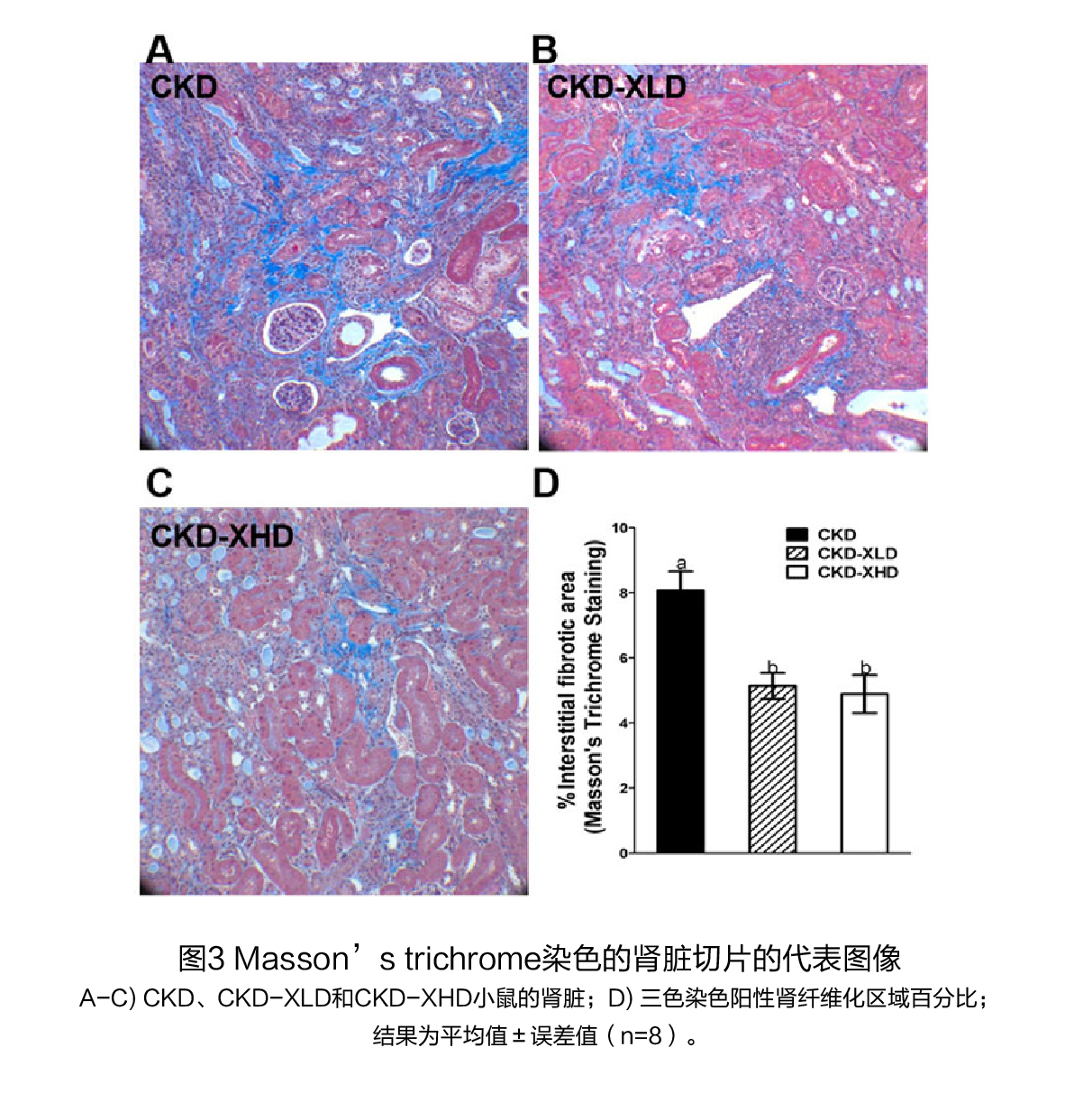
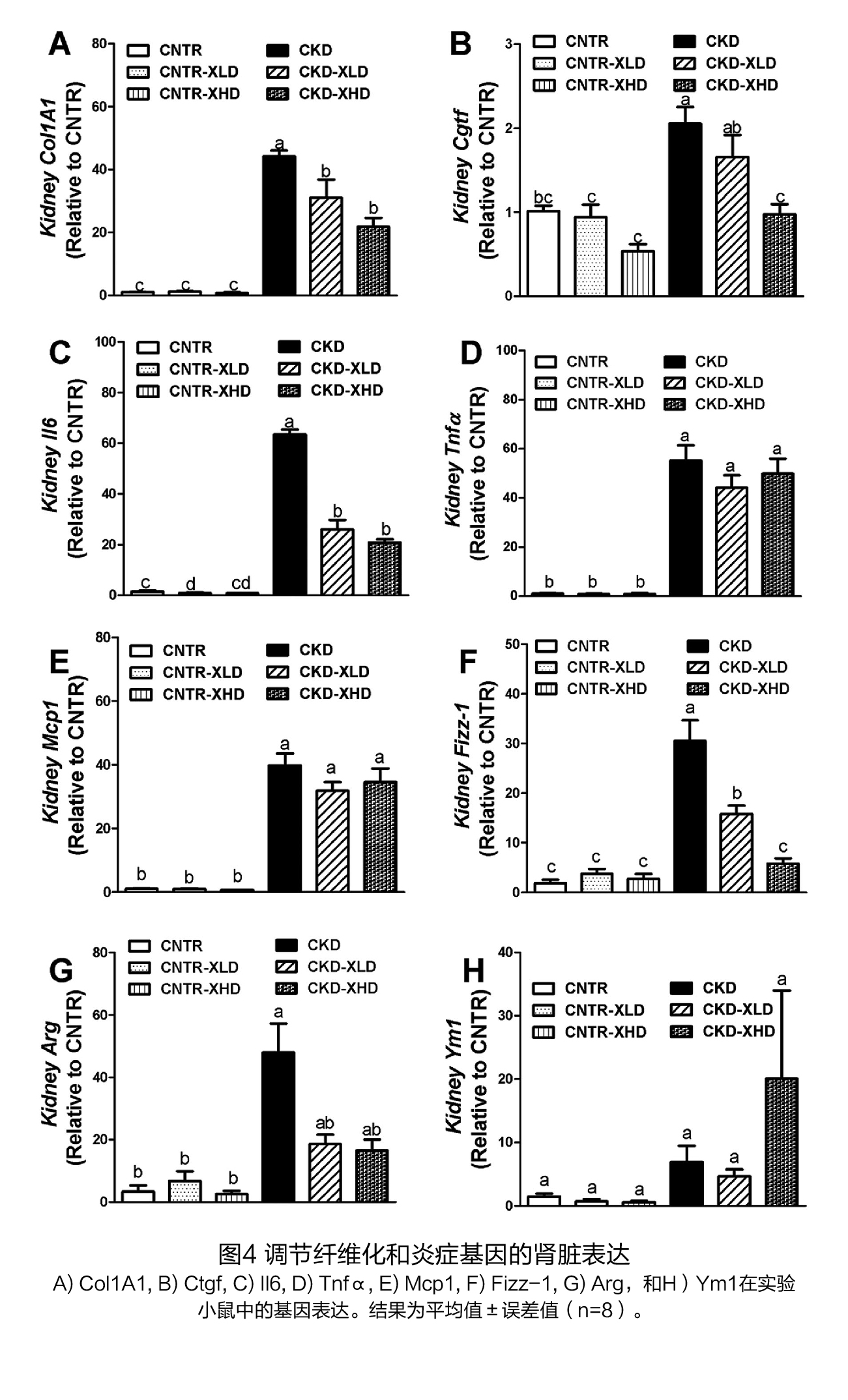
试验设计 试验对象:7周龄的C57BL / 6J雄性小鼠。 试验方法: 将小鼠随机分为6组,在前3周,三组饲喂AIN93M日粮(对照组),另外三组饲喂辅以0.2%腺嘌呤的AIN93M饮食以诱导CKD。在第三周结束时,停止腺嘌呤治疗,对照组(CNTR)和CKD小鼠接受补充低剂量(2%,XLD)或高剂量XOS(7%,XHD)的AIN93M饮食或对照AIN93M饮食,再喂养3周,实验设计流程见图1A。在第6周结束时,处死小鼠,收集血清和组织,检测肾脏标志物、炎症水平、尿毒症毒素、盲肠微生物组成和短链脂肪酸浓度等,并对肾脏进行组织学分析。 试验结果(1)膳食XOS对腺嘌呤诱导的肾脏损伤的影响 干预前:用腺嘌呤处理3周后,小鼠出现急性肾损伤,表现为血尿素氮(BUN)和肌酐水平升高,炎症和纤维化标志物的基因表达增加,水肿导致肾脏增大,体重减轻(图1A和图2)。将饮食改为不含腺嘌呤的对照饮食饲喂3周后,持续的肾脏损伤表现为BUN和肌酐水平持续升高(图1D,E);组织病理学特征包括皮质的肾小管面积减少,肾小管扩张,局灶性肾小管上皮损伤/坏死,炎症细胞浸润和轻度纤维化(图2A、C、D),以及炎症细胞因子(Il6、Tnfα和Mcp1)、M2巨噬细胞(Fizz-1、Arg和Ym1)和纤维化标志物(Col1A1和结缔组织生长因子[Ctgf])的基因表达增加(图4)。 干预后:在CKD小鼠中,XOS(2%和7%)的干预降低了BUN和肌酐水平(图1B、D、E),并促进了肾小管的再生(图2B、E、F)。通过Masson's trichrome染色和纤维化标志物Col1A1和Ctgf的基因表达,XOS(2%和7%)的处理减少了CKD小鼠的间质纤维化(图3和4A、B)。在CKD小鼠中,Il-6和Fizz-1的表达水平也因XOS的干预而显著下降(图4C、F)。 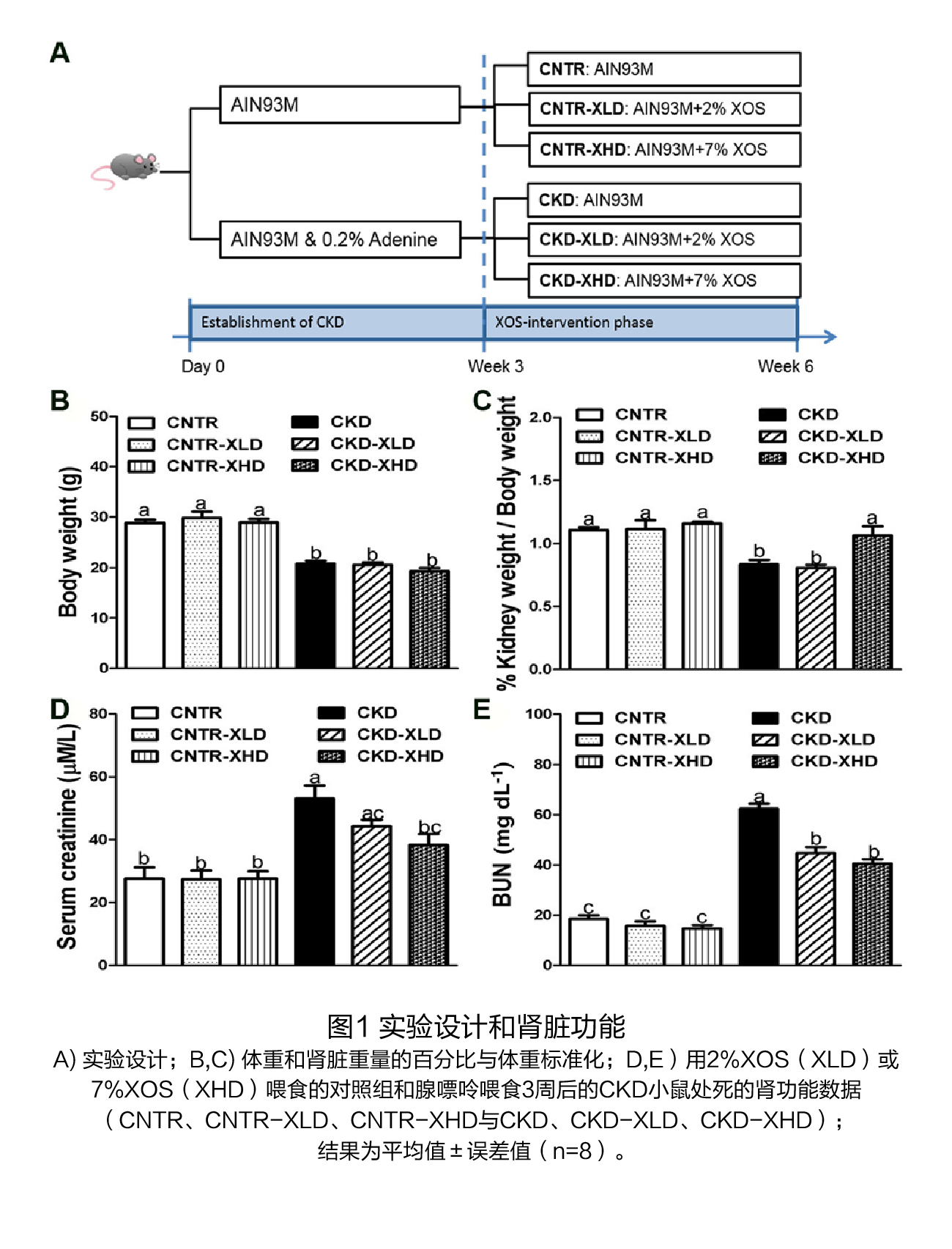
(2)膳食XOS对盲肠中微生物组成的影响 对照组(CNTR)和CKD小鼠的α多样性指数(Chao1和Shannon)相似(图5A、B),而饲喂含7%XOS的饮食后,CKD小鼠的物种丰富度(Chao1)显著下降(图5A)。当使用由β多样性分析产生的未加权和加权UniFrac距离指标来检测组间距离时,不同实验组的小鼠倾向于形成不同的聚类(图5C、D)。 在门水平上,在第6周结束时,对照组和CKD小鼠之间的细菌丰度无显著性差异(表1)。XOS干预后,放线菌门的丰度在对照组和CKD小鼠中都表现出下降的趋势(表1)。 在属水平上,共有9个菌属在CKD小鼠中富集(图6A),补充XOS后显著降低了6个菌属的丰度,包括Clostridium, unclassified Erysipelotrichaceaegenus、Staphylococcus、Dorea、Allobaculum和乳酸菌属(图6B、D、F-I),但没有降低Coprobacillus、Ruminococcus和Blautia(图6C、E、J)。 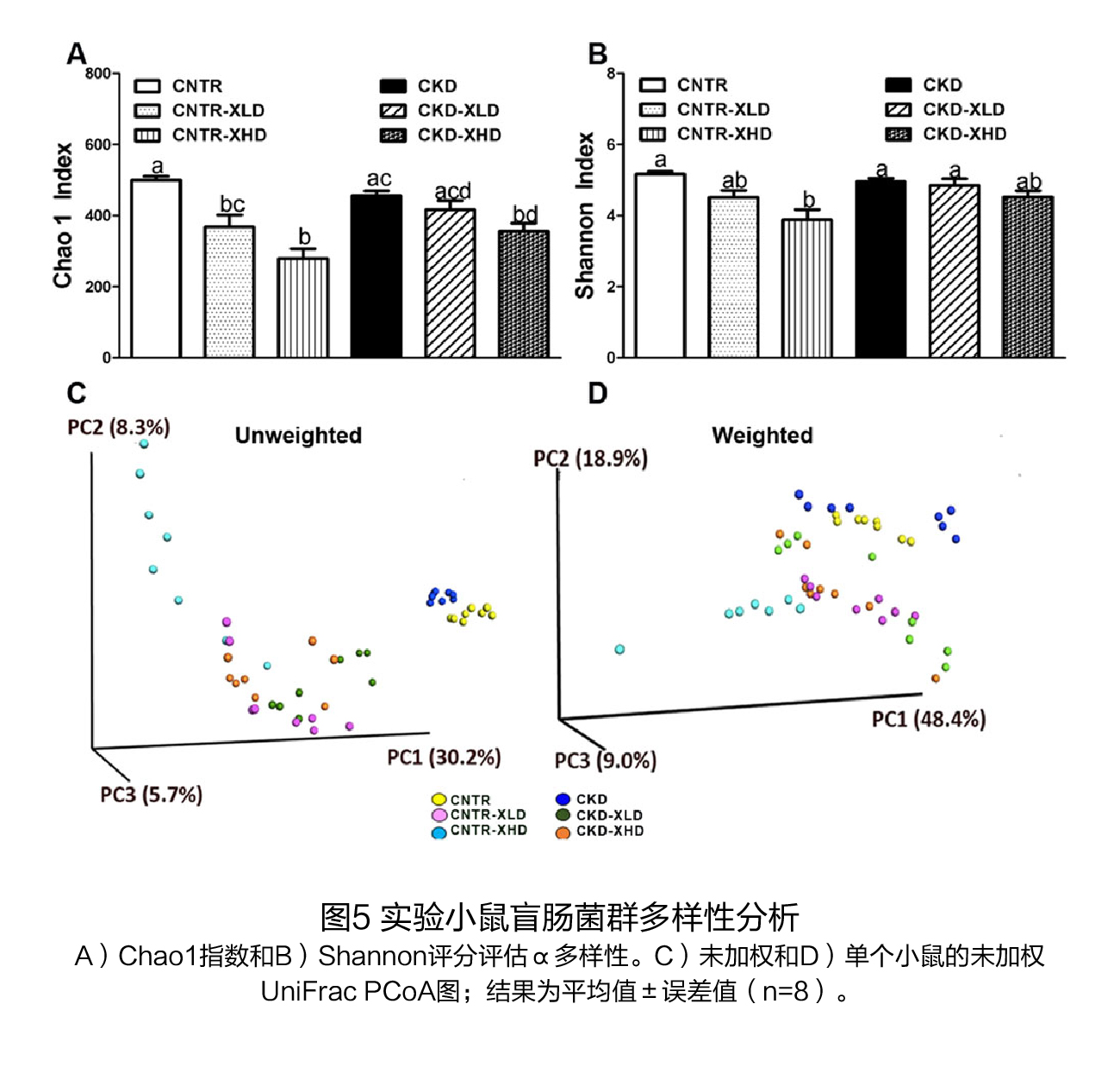 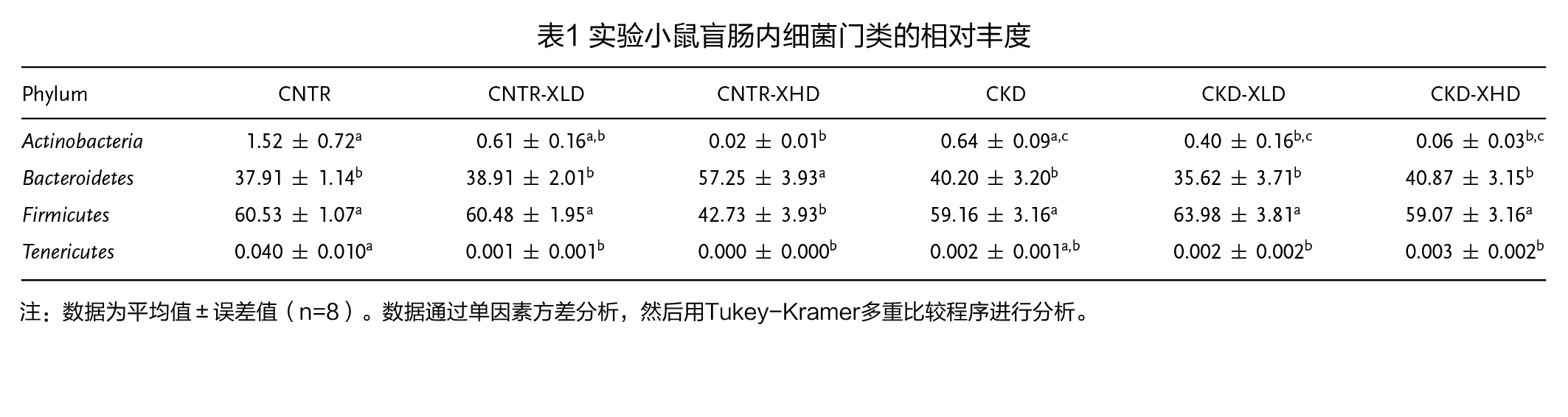 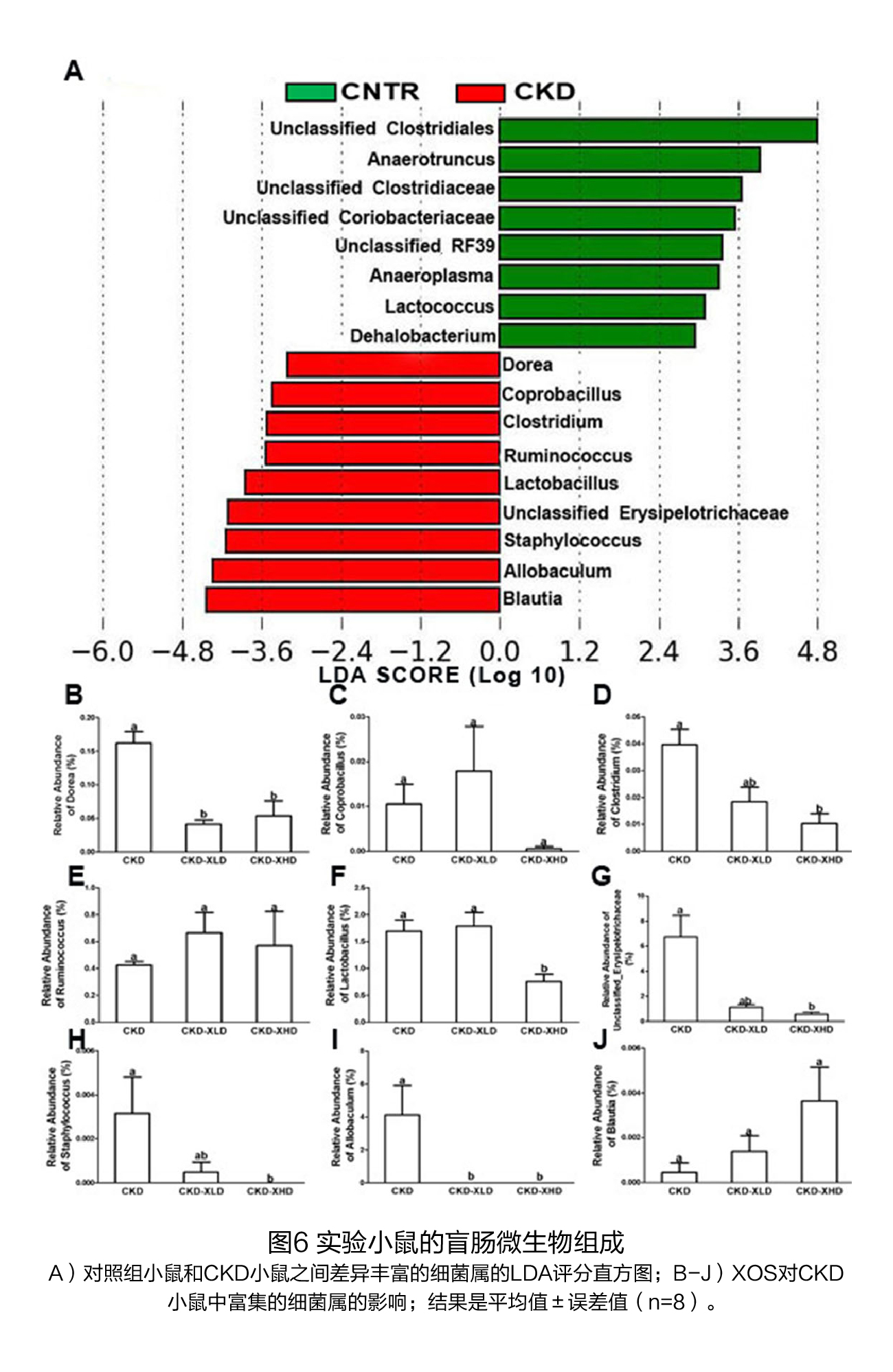
(3)XOS干预对CKD小鼠盲肠细菌预测功能的影响 如图7A所示,对照组小鼠的盲肠细菌显示出丰富的细胞运动和信号转导KEGG通路,而CKD小鼠的盲肠细菌富含12条特征性的KEGG通路。在这12条途径中,有10条在低剂量和/或高剂量XOS的补充下有所减少,包括癌症、碳水化合物代谢、遗传信息处理、免疫系统、传染病、代谢性疾病、信号分子和相互作用、萜类和聚酮类化合物的代谢、翻译、复制和修复(图7B-M)。 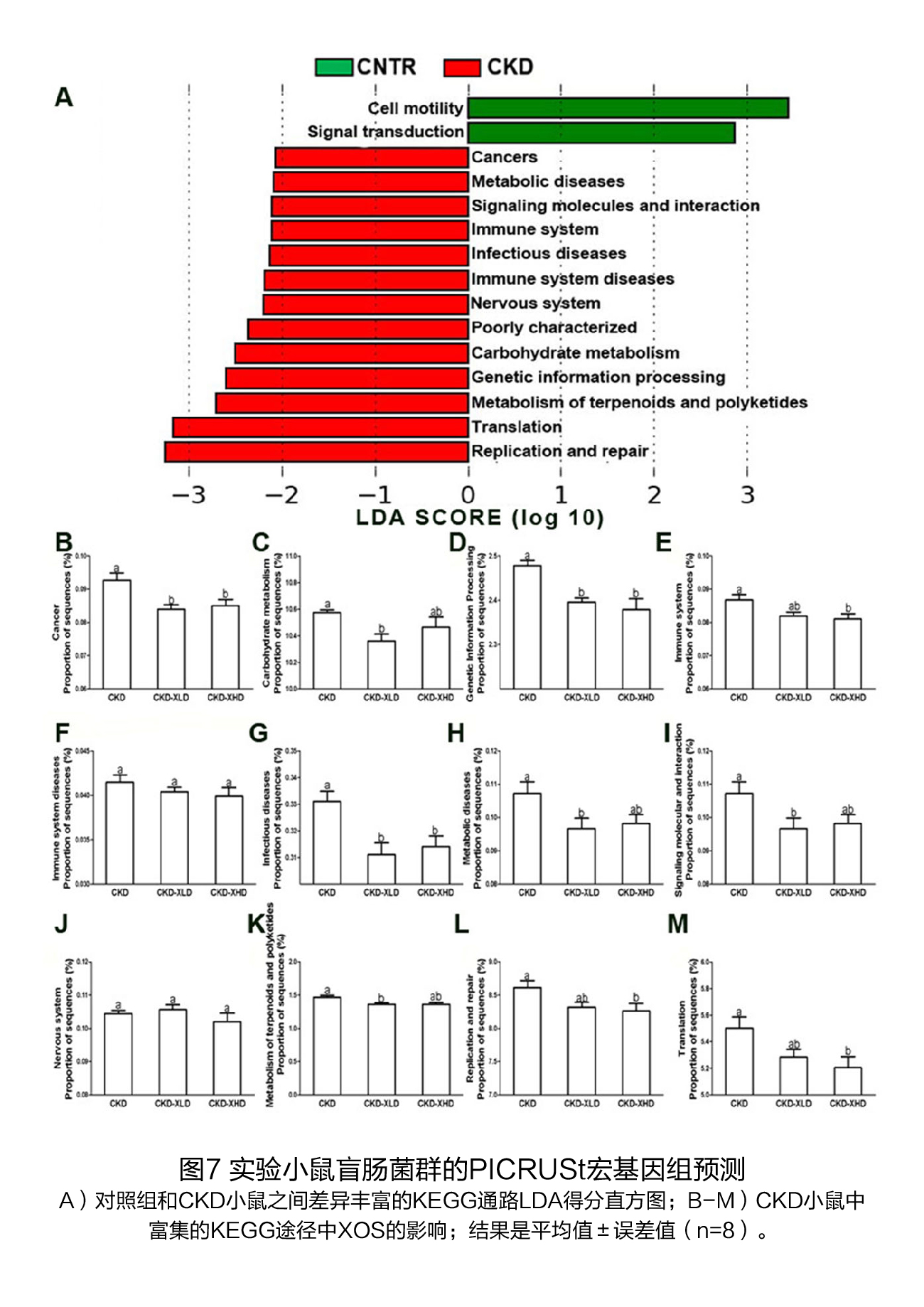
(4)盲肠短链脂肪酸浓度 对照组和CKD小鼠盲肠中短链脂肪酸的浓度无显著差异,两种剂量XOS处理的CNTR小鼠和高剂量XOS处理的CKD小鼠都导致了盲肠SCFAs总量、乙酸和丁酸浓度的增加(表2)。在CNTR小鼠中,XOS增加了丙酸的浓度,但对CKD小鼠没有影响(表2)。在CNTR和CKD小鼠中,XOS的补充没有改变血清中SCFAs的浓度(表3)。然而,与CNTR小鼠相比,无论是否补充XOS,CKD小鼠血液中的丁酸水平显著升高,而丙酸浓度则显著降低(表3)。 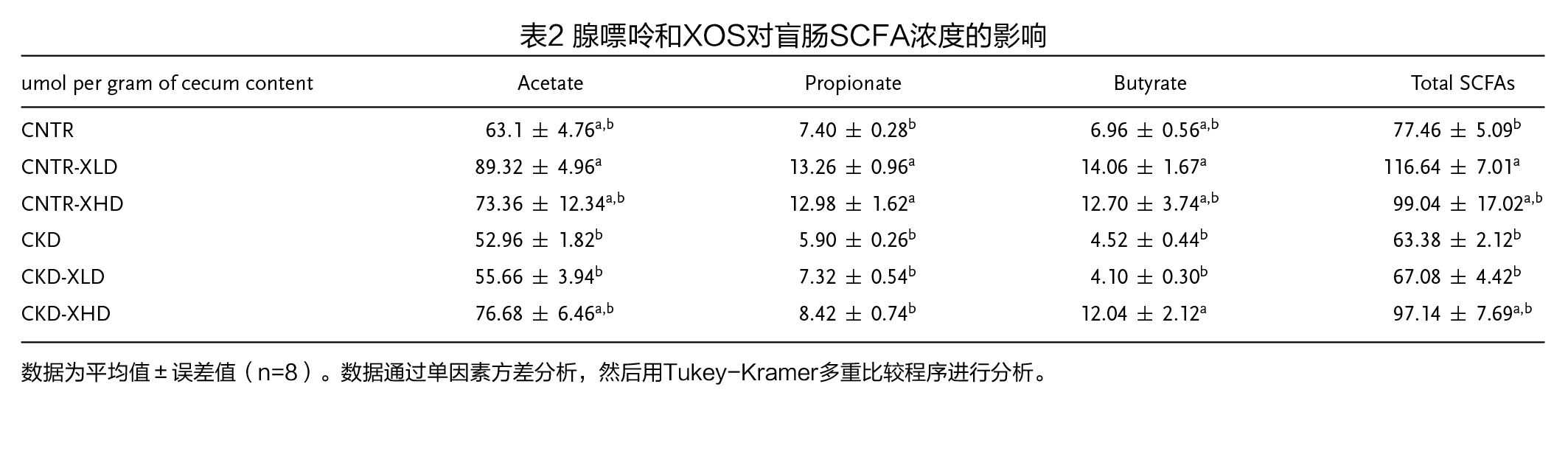 
(5)XOS干预对尿毒症毒素的影响 与对照组相比,CKD小鼠血清中硫酸吲哚盐和对硫甲酚的水平显著升高(图8A、B),XOS的干预完全地降低了对照组和CKD小鼠血清中的对硫甲酚的浓度。对硫甲酚来源于大肠中酪氨酸的细菌发酵/代谢。使用PICRUSt评估因细菌组成变化引起的代谢变化,证实CKD小鼠的酪氨酸代谢显著增加,而XOS的干预扭转了这种趋势(图8A、C)。 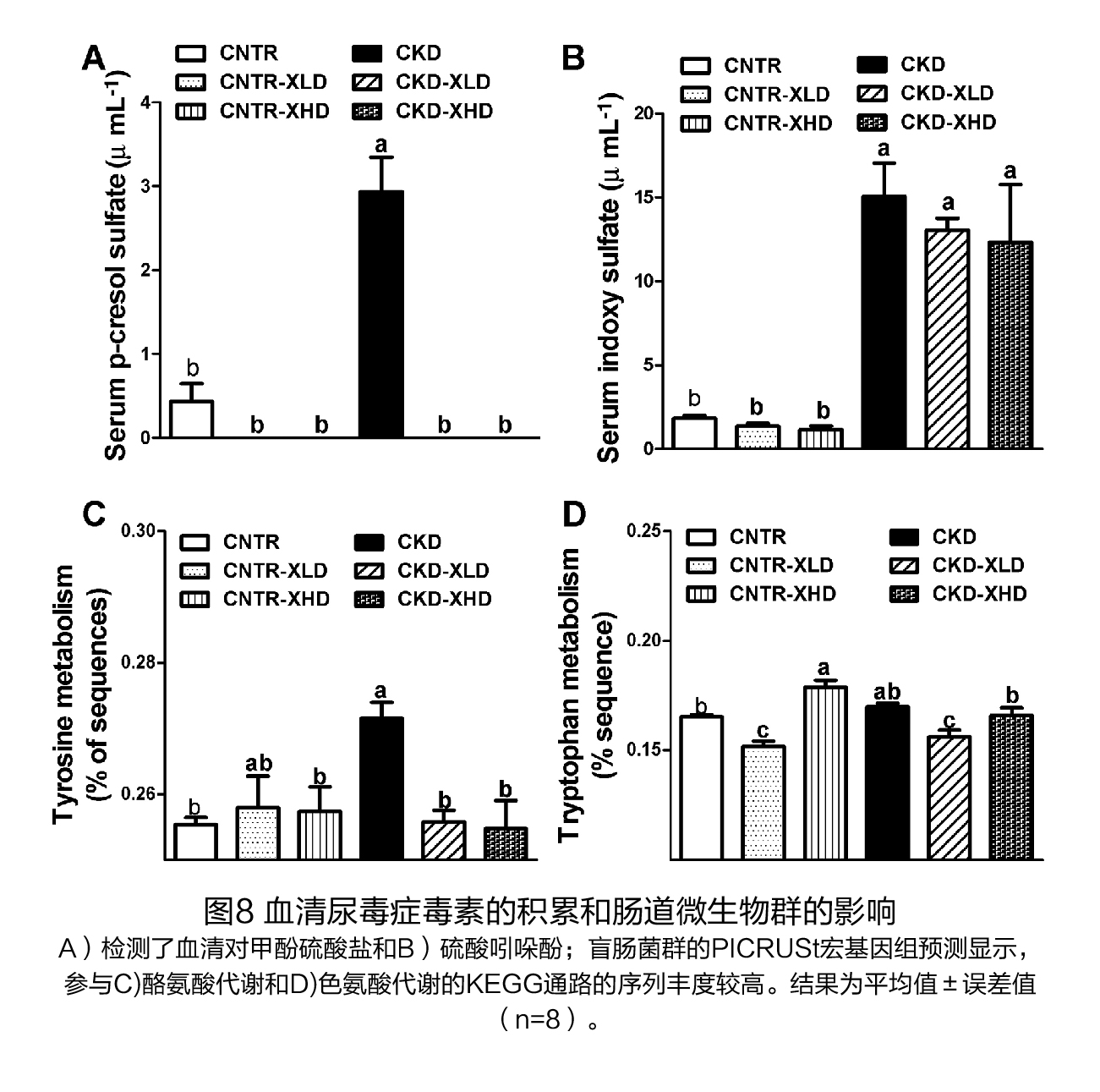
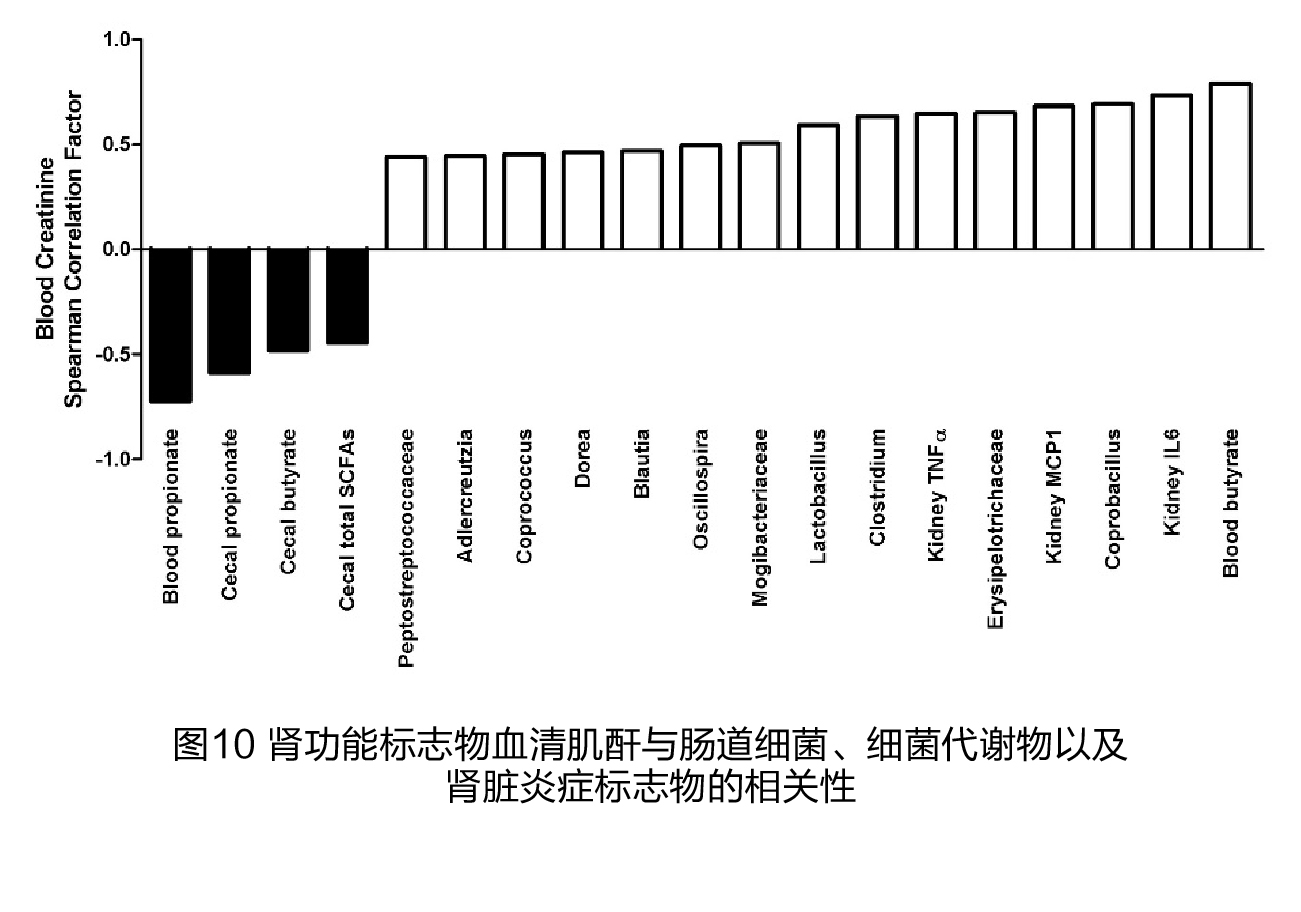
(6)肾功能与盲肠细菌、循环和盲肠SCFAs的关系 11种细菌与BUN(图9)、12种细菌与血清肌酐(图10)之间存在显著的正相关关系。其中有9种细菌与BUN和血清肌酐水平都呈正相关,包括Peptostreptococcaceae、Staphylococcus、Ruminococcus、乳杆菌属、Mogibacteriaceae、Clostridiaceae、Dorea、Coprobacillus、Blautia、Clostridium和Erysipelotrichaceae;Dehalobacterium属与BUN呈显著负相关关系。血清中的丙酸以及盲肠中的SCFAs与BUN和血清肌酐呈负相关关系。然而,血液循环中的丁酸与BUN和血清肌酐之间有很强的正相关关系。 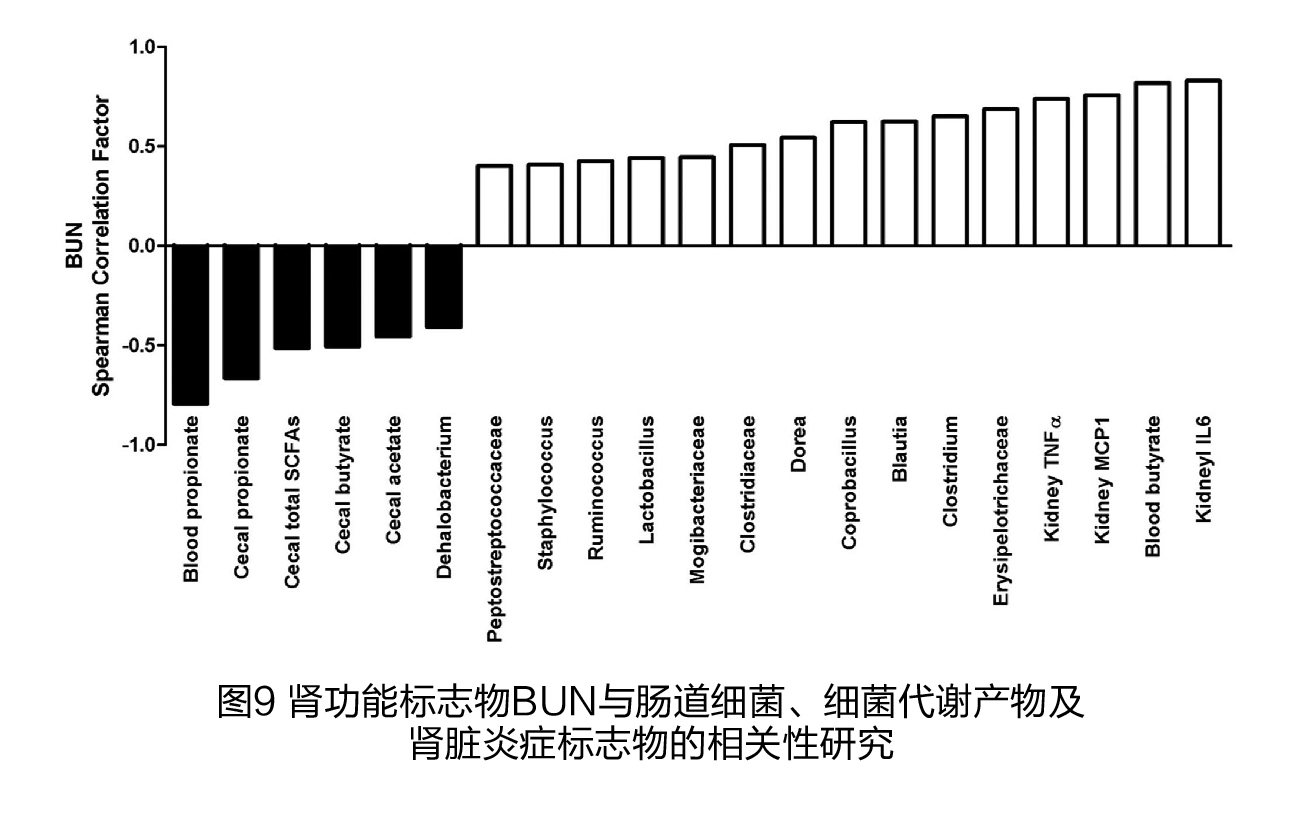
(7)XOS干预对微生物防御相关基因表达的影响 与CNTR小鼠相比,CKD小鼠回肠中抗菌肽(Defa5)的基因表达明显较高,被XOS处理后有下降的趋势(图121A)。未分类的S24-7属的相对丰度与Defa5的表达水平成反比(图11E)。 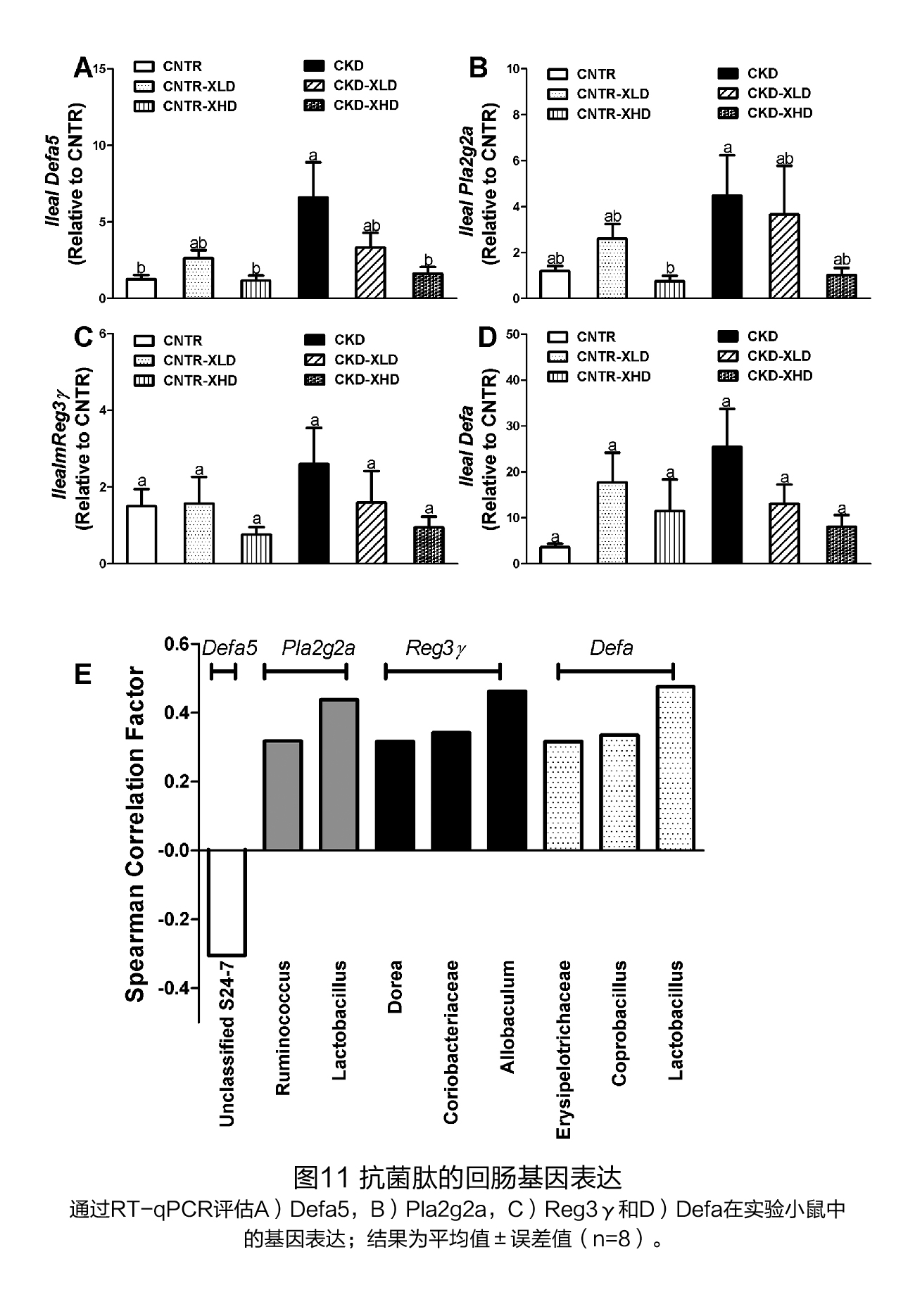
试验结论 试验表明,益生元XOS干预可以改善CKD小鼠的肾功能,并可引起盲肠菌群组成和功能的显著变化。通过改善肠道微生物群、提高SCFA浓度和减少细菌性尿毒症毒素,饮食XOS干预可能是缓解CKD进展的潜在治疗方法。 参考资料: Jieping Yang, Qing Li.et al. Effects of Prebiotic Fiber Xylooligosaccharide in Adenine-Induced Nephropathy in Mice[J]. Molecular Nutrition & Food Research, 62, 1613-4125, 2018
| 